☆目次
はじめに
神経回路網は化学シナプスを介したニューロンの相互作用によって動作していると考えられています。しかしながらシナプス伝達だけでは説明のつかない、多様な情報伝達機構の存在が明らかとなっています。
特にグリア細胞の一種のアストロサイトは、これまで補助的な役割しか持たないとされてきましたが、生体脳内で神経回路の情報処理に積極的に関わっている可能性が示唆されています。アストロサイトはニューロンと違い、活動電位を発生しないため、従来の電気生理学的測定においてはその寄与が見逃されてきた可能性があります。一方、神経伝達物質の受容によって有意に細胞内カルシウム濃度 (Ca2+)が上昇することが知られています。さらにそれに伴い様々なグリア伝達物質を放出し、神経修飾物質の細胞外空間への拡散伝達を介在することで広範囲の神経活動を長期に渡って修飾することが報告されています。
参考・推薦図書
- 毛内拡 著 脳を司る「脳」 講談社
- 工藤佳久 著 改訂版もっとよくわかる!脳神経科学〜やっぱり脳はとってもすごいのだ〜 羊土社
- 宮川博義・井上雅司 著「ニューロンの生物物理 第2版」丸善出版
代表的な論文
- H. Monai, S. Koketsu, Y. Shinohara, T. Ueki, P. Kusk, NL. Hauglund, AJ. Samson, M. Nedergaard & H. Hirase, Adrenergic inhibition facilitates normalization of extracellular potassium after cortical spreading depolarization, Sci Rep 11, 8150 (2021). https://doi.org/10.1038/s41598-021-87609-w
- H. Monai, X. Wang, K. Yahagi, N. Lou, H. Mestre, Q. Xu, Y. Abe, M. Yasui, Y. Iwai, M. Nedergaard, H. Hirase, Adrenergic receptor antagonism induces neuroprotection and facilitates recovery from acute ischemic stroke, Proceedings of the National Academy of Sciences, , DOI: 10.1073/pnas.1817347116
- Y. Ue*, H. Monai*, K. Higuchi, D. Nishiwaki, T. Tajima, K. Okazaki, H. Hama, H. Hirase, A. Miyawaki, A spherical aberration-free microscopy system for live brain imaging, Biochem Biophys Res Commun, Volume 500, Issue 2, 2 June 2018, Pages 236-241. DOI: 10.1016/j.bbrc.2018.04.049
*These authors contributed equally to this work. - H. Monai, M. Ohkura, M. Tanaka, Y. Oe, A. Konno, K. Hirai, K. Mikoshiba, S. Itohara, J. Nakai, Y. Iwai, H. Hirase, Calcium imaging reveals glial involvement in transcranial direct current stimulation-induced plasticity in mouse brain., Nature communications, Mar 2016;7:11100
- H. Monai, M. Inoue, H. Miyakawa, T. Aonishi, Low-frequency dielectric dispersion of brain tissue due to electrically long neurites. Physical Review E, Dec 2012;86(6-1):061911.
☆卒論・修論 研究テーマの例
| 脳梗塞超急性期における脳の水チャネル分子アクアポリン 4 非局在化の評価法の確立 |
| 脳組織の光学特性を利用した水組成変性の評価 |
| 経頭蓋直流電気刺激が脳脊髄液と間質液の交換に与える影響の解析 |
| 慢性的な軽度のストレスからの回復におけるアストロサイトIP3/Ca2+シグナルの寄与の解明 |
| ガンマ周波数の光や音刺激が神経グリア回路網に与える影響の生理学的解析 |
| AAV発現系によるTDP-43発現マウスの作製 |
| ヒト特異的α1アドレナリン受容体をアストロサイトに発現したマウスの脳機能解析 |
| マウスにおける副交感神経のはたらきの可視化 |
| 真正粘菌原形質の管形成・選択のメカニズム |
| 噛みしめ習慣による学習(認知機能)効果を調べる |
| 腸からの栄養吸収後の迷走神経活性化惹起性の報酬応答のイメージング、及びストレス後の変化の観察 |
News & Media
 私たちの論文が2019年5月28日号のPNAS誌巻頭の今週の注目論文 “This Week in PNAS” の一つに選出されました。”Adrenergic receptor antagonism may reduce stroke damage”
私たちの論文が2019年5月28日号のPNAS誌巻頭の今週の注目論文 “This Week in PNAS” の一つに選出されました。”Adrenergic receptor antagonism may reduce stroke damage”
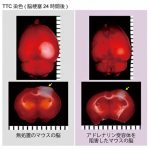 2019年5月20日 研究結果が プレスリリースされました。今回私たちは、脳梗塞 の超急性期に アドレナリン受容体 を阻害すると、脳損傷が最小限に食い止められることを発見しました。脳脊髄液 の クリアランス機構 によって細胞外カリウムイオン濃度の正常化が促進された結果と考えられます。
2019年5月20日 研究結果が プレスリリースされました。今回私たちは、脳梗塞 の超急性期に アドレナリン受容体 を阻害すると、脳損傷が最小限に食い止められることを発見しました。脳脊髄液 の クリアランス機構 によって細胞外カリウムイオン濃度の正常化が促進された結果と考えられます。
2018年5月7日 オリンパスと共同開発した顕微鏡システムに関する研究成果が報道発表されました。
G7NG817遺伝子改変マウスによる生体脳Ca2+イメージング
アストロサイトと一部のニューロンにCa2+センサータンパク質G-CaMP7を発現した遺伝子改変マウス(G7NG817マウス)を用いた生体脳Ca2+イメージングを主幹とした研究を行います。
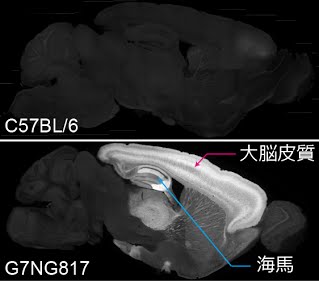
マウス固定脳における蛍光の発現パターン の矢状面(左右に分ける面)の断面図
上: 比較用の野生型(C57BL/6)マウス脳。
下: 作製した G7NG817 マウス脳。大脳皮質と海馬の一部に著しい G-CaMP7 の発現がみられる。この強い発現のために、蛍光変化を頭蓋骨越しに測定することができる。
G7NG817マウスは、大脳皮質における蛍光タンパク質の発現が高いため、実体蛍光顕微鏡下で、骨を削ることなく頭蓋骨越しにCa2+動態を計測することができます。
例えば、ウレタン麻酔下や徐波睡眠時に見られる特徴的な低周波・高振幅の脳波に対応するCa2+振動を計測することができます (下図)。
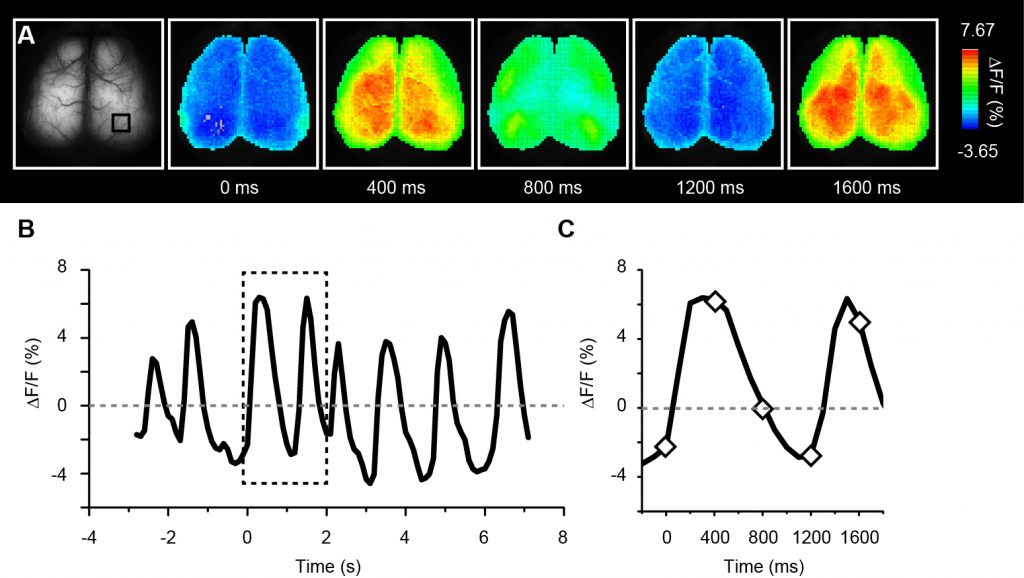
ウレタン麻酔下のG7NG817マウスにおける徐波に対応するCa2+蛍光輝度変化の経頭蓋イメージング
(A). 麻酔下のG7NG817マウスでは、高振幅・低周波数で特徴付けられる自発的なCa2+振動が全皮質に渡って、左右脳で同期して観測される。その蛍光輝度変化率 (ΔF/F)を疑似カラーで表示した。
(B). Aで右脳視覚野 (四角で囲った部位) における平均輝度変化率 (ΔF/F)をプロットした図。Ca2+濃度振動の周波数は0.5 から 2 Hz程度で、脳波記録で報告されている徐波振動と同様の値である。記録は10 Hzのフレームレートで行なった。
(C). Bで点線で囲った部位を拡大した図。ひし形で示した点に対応する画像をAに示した。
一方、テールピンチ刺激によっては、脳波同様、速波化が誘発されると予想しましたが、予想とは異なり非常に明るくゆっくりとした応答が得られました。
そこで頭蓋骨に観測用の窓を設け、二光子顕微鏡を用いてより詳細な観測を行なったところ、このCa2+シグナルはアストロサイト由来であることを見出しました (下図)。
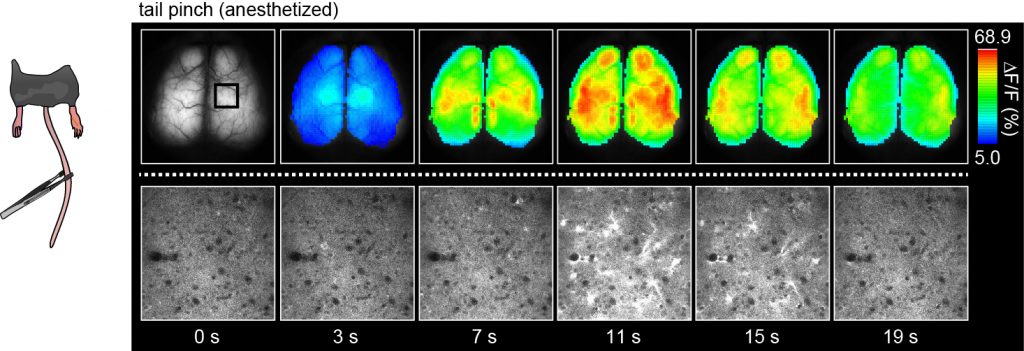
ウレタン麻酔下のG7NG817マウスにおけるテールピンチ刺激に対する応答の経頭蓋イメージング
(上段) 蛍光輝度変化率を疑似カラー表示した。変化率のピーク値と応答の時間経過が、自発的な応答の約10倍高い値を示すことに注目。
(下段) 上段とは別の個体で、体性感覚野 (図の四角で囲った部位)に開頭手術を施し、テールピンチ刺激に対する皮質第2/3層の応答を二光子顕微鏡で計測した。
ゆっくりとした時間経過で非常に明るく白く見える細胞は、アストロサイトである。
微弱な電気刺激が脳を活性化する仕組みを解明
経頭蓋マクロイメージングを利用して、経頭蓋直流電気刺激 (tDCS)の作用メカニズムを明らかにしました。
tDCSは、頭蓋骨の上から極めて微弱な電流を流すことによって脳を刺激する手法で、ヒトではうつ病の改善や、リハビリテーションの促進、さらには記憶力の向上などの効果が報告されており、様々な分野への応用が期待されています。
しかしながらその作用メカニズムは解明されていませんでした。
そこで、覚醒下のG7NG817マウスにtDCSを行なった結果、驚いたことに、非常に明るくてゆっくりとした応答が顕著に増加しました。
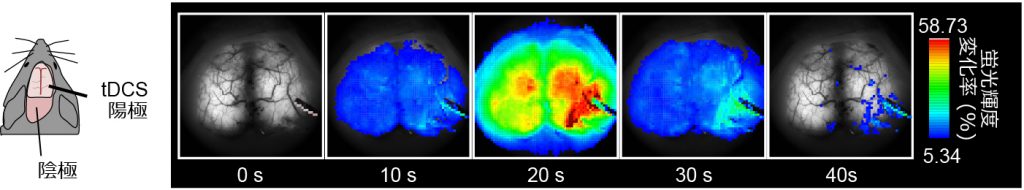
G7NG817 マウスの大脳皮質における tDCS 中のカルシウム動態
覚醒状態のマウスの脳を頭蓋骨越しに上からみている。右脳の一部に tDCS の陽極を置き、陰極は首の筋肉に設置し、0.1mA で 10 分間 tDCS を行った。電気刺激開始直後からゆっくりとした非常に明るいカルシウム応答が、左脳を含む大脳皮質全体にわたって起こった。これは一過性の応答で、電気刺激を与えている間だけ著しく増加した。
二光子顕微鏡で観測したところ、このCa2+上昇は、アストロサイト由来であることを見出しました。
一方、テールピンチとは異なり、ニューロンの応答には変化はありませんでした。
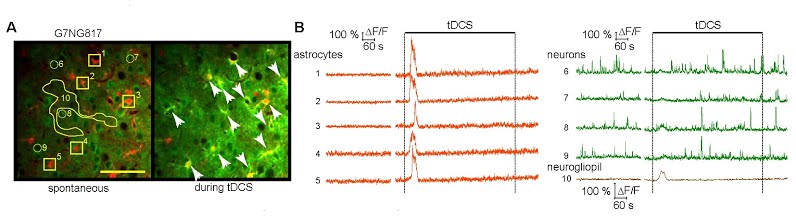
tDCSによって皮質第2/3層のアストロサイトのカルシウム上昇が引き起こされる。
(A) G7NG817マウスにおけるtDCS中の視覚皮質第2/3層の二光子顕微鏡による計測。アストロサイトはSR101で赤に染色されている。矢尻はtDCSによって細胞内Ca2+上昇が観測されたアストロサイトを示している。数字は図Bで時系列変化が描かれているニューロンとアストロサイトとニューログリオピルに対応している。スケールバーは100 μm。(B) 蛍光変化率 (ΔF/F)の時系列変化。アストロサイトがオレンジで、ニューロンが緑で、ニューログリオピルが茶色で示してある。
薬理学的実験からアストロサイトのCa2+上昇は、広範囲調節系の神経修飾物質であるノルアドレナリンが引き金となって生じることが分かりました。
tDCSによって誘導されるシナプス可塑性やうつ様行動の改善にもノルアドレナリンを介したアストロサイトのCa2+上昇が必須であることを見出しました (Monai et al., 2016, Nat. Commun.)。
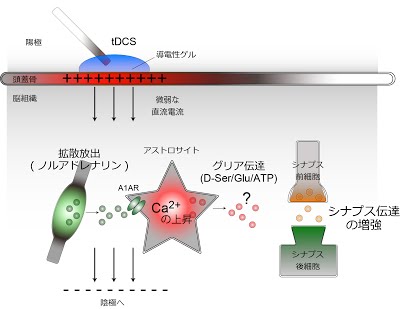
tDCS がマウスのシナプス伝達の増強を起こすモデル
マウス脳への微弱な直流電流(tDCS)によってノルアドレナリンの放出が促進され、ノルアドレナリン受容体(A1AR)を介してアストロサイトを活性化する(カルシウム濃度が上昇する)。その結果、シナプス伝達が増強される。アストロサイトが何らかの伝達物質を放出(グリア伝達)して、シナプス機能を調節していることが想定される。
生体脳深部観測と脳組織の生物物理学特性の解明
大脳皮質においては、長く複雑に分枝した神経突起を持つ神経細胞が方向性を持って配列することにより機能領野を形成しています。
機能領野内では、深さ方向に分布する細胞の種類や形態や分布の密度が異なる層構造をなし、層間での相互作用により情報処理を達成しています。
さらに機能領野が相互に連絡することで高次機能を達成していると考えられています。
このように本来複雑な構成を持つ脳組織に対して、これまでは個々の神経細胞の内部のタンパク質や分子の動態を明らかにする要素還元論的なアプローチや神経細胞間のネットワーク構造を明らかにするシステム論的アプローチが取られてきました。
脳組織を構成する細胞集団の配置や組織の形態や構造に着目した研究が重要であると考えられます。
脳組織は従来脂質からなる均質な媒質であるとみなされているようですが、脳組織の持つ構成的な特性や形態的な規則性は非常に興味深く思えます。
私はこれまで、脳組織の持つ異方性が脳組織の物理的特性や生体脳における機能創成に対して大きく寄与している可能性を提案して参りました (Monai et al., Phys Rev. E., 2012)。
本研究では、脳組織とりわけ高次機能を担っていると言われている大脳皮質の機能領野の層構造や異方性に着目して参ります。
生体脳における皮質組織が不均質媒質であることや単なる脂質からなる媒質でないことを明らかにした上で、組織の不均質性や異方性が脳機能の創成に果たす役割を解明したいと考えております。
本研究は理研BSI-オリンパス連携センター (BOCC)との共同研究で行なっていく予定です。
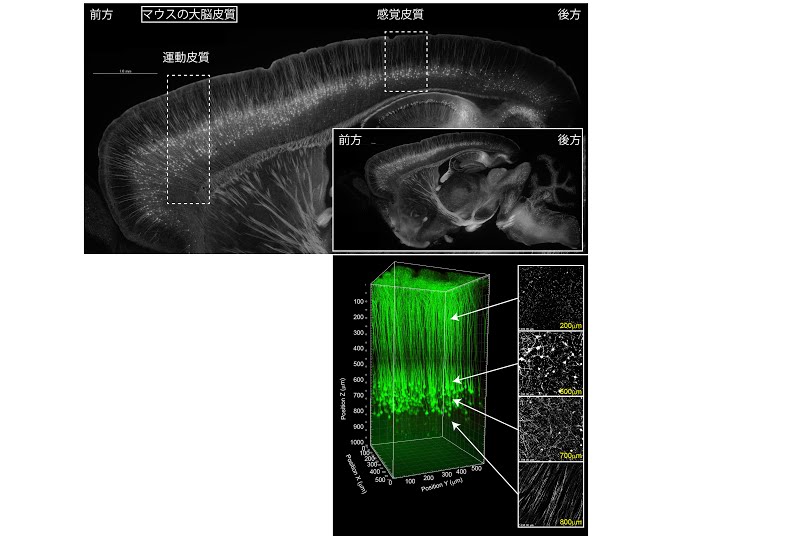
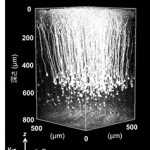
大脳皮質の規則正しい層構造
神経細胞の細胞質にYFPを発現した遺伝子改変マウスより作成した脳切片の図と感覚皮質における二光子像より三次元再構成した神経突起群。神経細胞の神経突起は規則正しく配列しており、さらに深さ方向においても突起の伸長方向に規則性がある。撮影は理研BSI-オリンパス連携センターの協力を得て、FVMPE-RS二光子励起顕微鏡にて、WMP25x 水浸対物レンズを用いて行なった。
