(編集中)
V.アネキシンファミリータンパク質の機能に関する研究
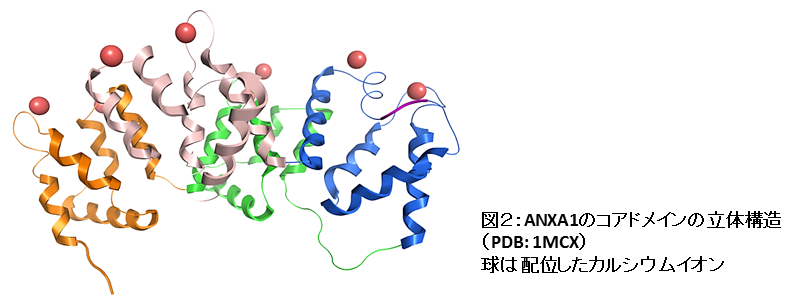
“アネキシン”はカルシウム結合タンパク質ファミリーで、ヒトゲノムには12種類のアネキシン遺伝子が見つかっています。図1にアネキシンの構造の特徴を、図2にヒトANXA1のコアドメインの立体構造を示しました。
アネキシンは始めにカルシウムイオン依存的に細胞膜や酸性リン脂質ホスファチジルセリンに結合性を持つタンパク質として発見されました。一方、私たちは 負電荷を持つ糖鎖であるシアリルオリゴ糖やヘパリンに結合するタンパク質を探索する研究の過程で、ウシ腎臓からp33/41を見いだしました [Kojima, K et al., J Chromatogr 597(1992)323-330.]。構造解析と遺伝子クローニングの結果、p33/41はアネキシンA4(ANXA4)と同一であることがわかり[Kojima, K. et al., J Biol Chem 267(1992)20536-20539., Kojima, K. et al., J Biol Chem 271(1996)7679-7685.]、その後、ANXA5とANXA6もグリコサミノグリカンに結合性があることを明らかにしました[Ishitsuka, R. et al., J Biol Chem 273(1998)9935-9941.]。グリコサミノグリカンへの結合活性は、アカパンカビや、線虫 C. elegansのアネキシンにもあることを明らかにし[Nishioka, S. et al., J Biochem 141(2007)837-848.]、様々な生物種に発現されているアネキシンが共通に持っている活性であると考えています。
アネキシンファミリーのタンパク質は多細胞生物に広く発現されており、ヒトでは赤血球を除くすべての細胞に、一つ以上のアネキシンが発現されていると考 えられています。アネキシンはヘパリン/ヘパラン硫酸、ポリリン酸などの負電荷性の生体分子と相互作用することから、アネキシンはこれらの負電荷性分子が 活性化する生体内反応や複合体形成のレギュレーターとして働いていると考え、その機構解明を目的に研究を進めています。
テーマ1:抗凝固/抗血栓タンパク質 ANXA4とANXA5の活性発現機構
血液凝固系や血栓形成の亢進は、日本の三大死因である疾患-心筋梗塞、脳梗塞、がん-と直接的・間接的に関与しています。血液の流動性の維持は酸素や栄 養成分の体内運搬のために必須であり、本来厳密に制御されています。また、血液凝固反応は出血により体内から血液が失われることを防ぎ、また体内で病原菌 が増殖・播種する事を阻止する生理的な生体防御反応です。しかし、血管壁の性状の変化、血液成分の変化、血流の変化などでその調節機構がうまく働かなくな ると血栓傾向が亢進します。
胎盤の抗凝固タンパク質placental anticoagulant protein I と IIは、ANXA5とANXA4と同じタンパク質で、in vitroで強い抗凝固活性があることが以前から明らかにされていました。最近、北里大・汾陽らのグループがANXA5の遺伝子欠損マウスでは、産仔数が減少すること報告し[Sci Rep. 2(2012)827.]、生体内でもANXA5が血流の凝固性の調節や、血栓形成抑制に関わることを示しました。
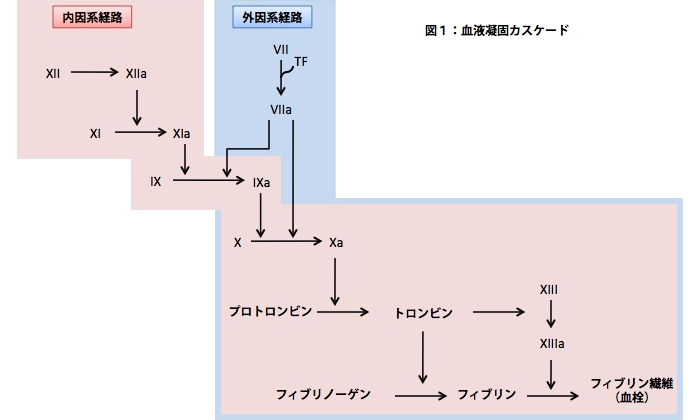
私たちはANXA4とANXA5が持つ血液凝固性調節のしくみを明らかにしたいと考えています。血液凝固カスケード反応(図1)のどの因子の活性化の抑 制に関与するのか、リガンドの同定、ANXA4やANXA5分子上のリガンド結合部位、活性を持つ最小ペプチド単位の特定などを進めています。
(作成中)
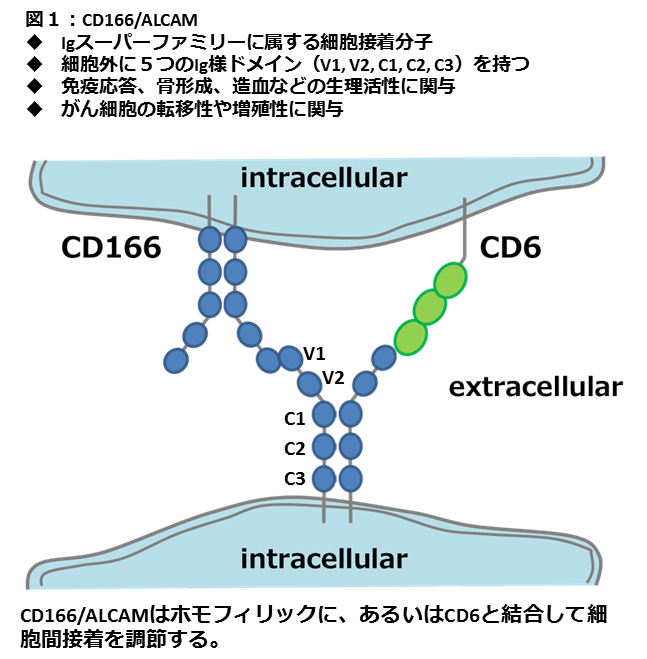
VI. CD166/ALCAMと癌細胞の転移性に関する研究
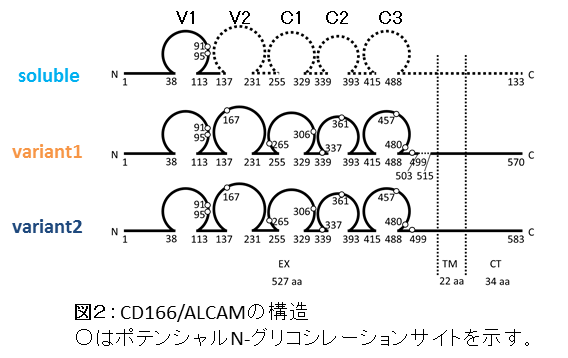
細胞接着因子CD166/ALCAMは膜貫通型の糖タンパク質(図1)で、ポテンシャルN-グリコシレーションサイトが10カ所、さらにはO-グリカン 修飾も受けることが知られています(図2)。私たちは癌特異的に発現する糖鎖エピトープを認識するモノクローナル抗体に関する研究から、 CD166/ALCAMのO-グリコシド型糖鎖構造の違いが転移性と関連がある可能性を見いだし[Oikawa, F. et al., Cancer Sci 104(2013) 62-69]、検証を進めています。
III. β-プリズムフォールドタンパク質の構造と機能に関する研究
(作成中)