本研究は、ブタ膵α-アミラーゼとウシ肝β-グルクロニダーゼという異なる2つの酵素に関する別々の目的をもった研究から生まれました。酵素が本来もつ、基質結合活性とは異なる糖質結合性がそれぞれに見つかり、それらの糖結合性にはいくつかの共通点があるという予期しなかった事実から始まった研究です。これらの結果は、天然の多くのタンパク質分子には糖鎖情報を認識する性質が潜在しており、これらの性質がまだ明らかにされていないこと、すなわち糖鎖がもつ機能もまだ多くは未解明のままであることを示すものと捉えられます。
膵臓α-アミラーゼは糖タンパク質N-結合型糖鎖に結合する
α-アミラーゼはα-1,4結合で連なるグルコース配列をランダムに切断するエンド型のデンプン分解酵素で、動植物や微生物などの多くの生物がエネルギーを得る過程で必要な役割を果たします。膵液中のα-アミラーゼ活性は、糖尿病治療の観点からも、阻害剤や反栄養素との相互作用が最もよく調べられている酵素のひとつです。一方、私達はマメ科植物レクチンの機能に関する研究 1) との関わりで興味を持ち、以前からレクチンは反栄養素のひとつと捉えられてきたことと、特にインゲン豆レクチンがα-アミラーゼ阻害剤との配列相同性を持つことから生体防御分子に分類され、実際に昆虫生育阻害作用を示すという報告 2) に関心を持ちました。そこで、ブタ膵臓α-アミラーゼ(PPA)と種々の植物レクチン、およびレクチン以外の糖タンパク質との相互作用を調べました。その結果、予想外にもPPAが糖鎖認識能力を持ち、N-型糖鎖を持つ糖タンパク質に結合することが見つかりました 3) 。試験管内ではレクチンとの結合によってPPAの酵素活性は阻害されず、むしろ活性化されたのです。1830年に発見されて以来、170年以上もの間、幅広く数多くの研究が為されてきたPPAに未知の側面が残っていたことは意外でした。
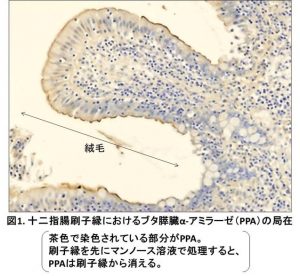
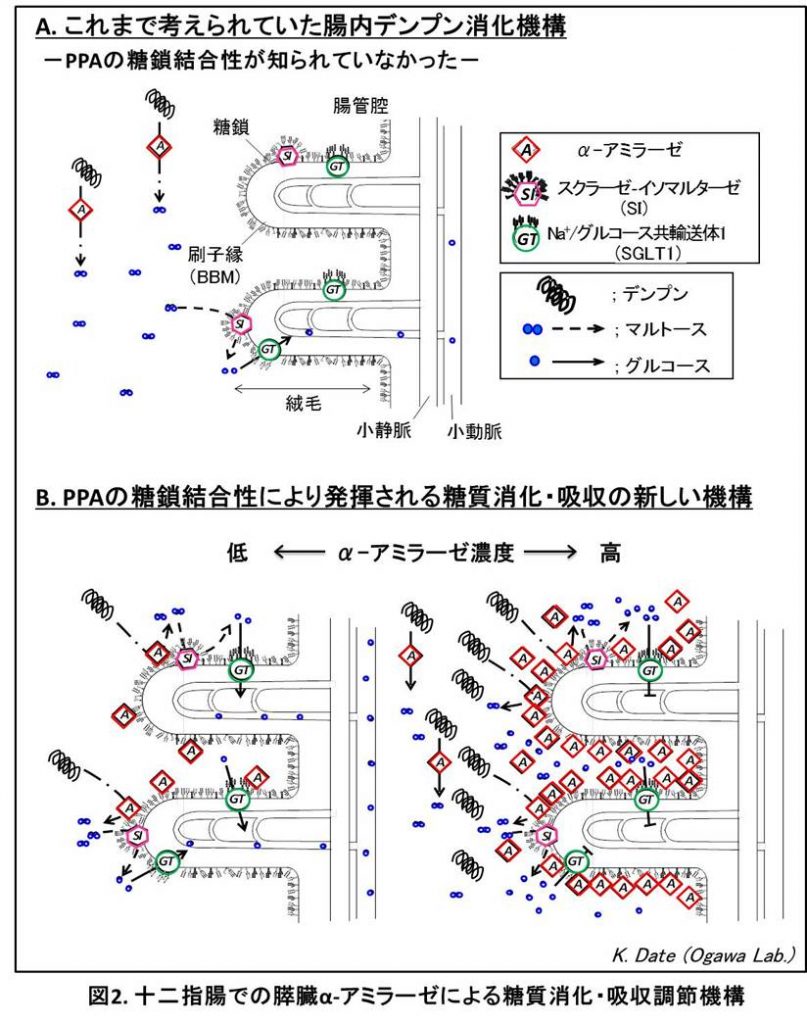
その後私達は、生体内では膵臓で合成されたPPAが腸管に分泌された後、十二指腸内腔の刷縁子膜 (BBM) の糖鎖に対して結合していることを見出しました(図1)。PPAはその糖鎖結合性を介して、BBMにあるスクラーゼ・イソマルターゼ(SI) や、Na+/グルコース共輸送体1 (SGLT1) などの、糖質代謝・吸収に関わるいくつかの膜糖タンパク質に結合していたのです。さらに、PPAのデンプン分解活性はBBMに結合することによって2倍以上に増強し、SIのマルトース分解活性もPPAが結合することにより増強しました。逆に、SGLT1のグルコース輸送活性は食物消化時のやや高濃度のPPAにより著しく阻害されることを見出しました 4) 。この発見から、PPAはBBMとの糖鎖特異的結合により、腸管でのデンプン分解とグルコース生成を促進する一方、腸上皮細胞によるグルコース吸収を阻害して食物消化直後の血中糖濃度の急激な上昇を抑制する調節機能をもつと考えられます(図2)。PPAに見出された糖タンパク質のN-型糖鎖に対する結合性は、ヒトの膵臓α-アミラーゼも共通に持つ性質であることがわかりました。 4) 。
私達はリソソーム酵素であるβ-グルクロニダーゼ にはラクトース/ラクトサミン結合性を発見しました 5) 。現在これらの酵素をはじめ、様々な消化酵素の持つ糖鎖結合性ならびにその生物学的機能について研究しています。
1) Ueda H., et al., Biochem. J. , 382 , 821-825, (2004)
Solubility-insolubility interconversion of sophoragrin, a mannose/glucose-specific lectin in Sophora japonica (Japanese pagoda tree) bark, regulated by the sugar-specific interaction.
⇒Full Text
2) Chrispeels, MJ and Raikhel, NV., Plant Cell , 3 , 1-9 (1991)
Lectins, lectin genes, and their role in plant defense.
⇒Full Text
3) Matsushita H., et al., J. Biol. Chem. , 277 , 4680-4686, (2002)
Porcine pancreatic alpha-amylase shows binding activity toward N-linked oligosaccharides of glycoproteins.
⇒Full Text
4) Asanuma-Date K., et al., J. Biol. Chem. 287 ,23104-23118, (2012)
Functional Regulation of Sugar Assimilation by N-Glycan-Specific Interaction of Pancreatic α-Amylase with Glycoproteins of Duodenal Brush Border Membrane.
⇒Full Text
5) Matsushita-Oikawa H., et al., Glycobiology , 16 , 891-901, (2006)
Novel carbohydrate-binding activity of bovine liver beta-glucuronidase toward lactose/N-acetyllactosamine sequences.
⇒Full Text
●膵臓トリプシンも糖タンパク質・糖鎖に結合する
α-アミラーゼの糖結合性は哺乳類膵臓由来のものに限定され、唾液や植物、微生物由来の酵素には該当する糖結合性が認められませんでした 1) 。そこで私達は他の膵臓酵素にも糖結合性があるかどうかを調べたところ、膵プロテアーゼであるトリプシンにもよく似た糖結合性があることがわかりました。ウシ、ブタのトリプシンは糖タンパク質のN-型糖鎖に結合します。詳細な糖特異性にはα-アミラーゼとは異なる点もありました 6) 。トリプシンは糖鎖との結合によって活性化しましたので、腸管内で他のチモーゲンを活性化して消化作用のイニシエーターとなるトリプシンの役割から、この糖鎖結合性は消化促進に寄与すると考えられました。
6) Takekawa H., et al., J. Biol. Chem. , 281 (13), 8528-8538, (2006)
Novel carbohydrate-binding activity of pancreatic trypsins to N-linked glycans of glycoproteins. ⇒Full Text