タンパク質抽出プロトコル
・・・準備段階・・・
藻体は水気を取って,コニカルチューブにいれ,液体窒素で瞬間冷凍し,-80で保存
可溶可バッファー Triton-X, Tween 20を準備
2.2%TritonX-100可溶化buffer
- 1M Tris-Cl (pH 7.5) 250μl [50mM]
- 2-メルカプトエタノール 110μl [0.31M]
- 10% TritonX-100 1.1ml [2.2%(v/v)]
- 137mM PMSF 292μl [8mM]
| Fill up to 5ml (DW) |
Tween-20 (Polyoxethylene(20)sorbitan monolaurate)可溶化buffer
- 1M Tris-Cl (pH 7.5) 250μl [50mM]
- 2-メルカプトエタノール 110μl [0.31M]
- 5% Tween-20 1ml [1%(v/v)]
- 137mM PMSF 292μl [8mM]
| Fill up to 5ml (DW) |
L solution
- Tris 36.4g [1.5M]
- ・10%SDS 8ml [0.4M]
| Fill up to 200ml (DW) |
上記の試薬をDWに溶かし200ml近くまでfill upし、conc.HClを用いてpH8.8に調整した。
M solution
- Tris 10g [0.5M]
- 10%SDS 8ml [0.4M]
| Fill up to 200ml (DW) |
上記の試薬をDWに溶かし200ml近くまでfill upし、conc.HClを用いてpH6.8に調整した。
N solution
- Acrylamide 60g [30%(w/v)]
- N,N’-Methylene-bis-acrylamide 2.16g [1.08%(w/v)]
| Fill up to 200ml (DW) |
- 10% Ammonium peroxdisulfate (APS)
- -20℃で保存。
- 10×Running buffer
- Tris 30g[250mM]
- Glycine 144g[1.92M]
| SDS 10g[1%(w/v)] |
Fill up to 1 liter (DW)
☆ゲル装置の組み立て☆
- ゲル板,コーム,ゴムバンドを洗浄(手袋を忘れずに)。
- DWをかけ,キムワイプで拭き,新しいキムタオルの上に置く。
- Gel moduleにガラスプレートとスペサーをセットする(凹板を下側にする)。
- 両サイドをクランプで挟み、スクリューを均等に締める。シーリングプレートを起こし、つまみをクランプの奥の窪みにはめ込む。
- コームをさし,その2cm下に矢印シールをはる。
- 70%エタノールをいれてみて漏れがないかチェック。
☆ゲルの作製☆
- Runningゲルの材料を三角フラスコにいれ,手で回しまぜる(下表参照)。
- 脱気はせずに,そのまま矢印シールのちょい上まで流し込む。
- 70%エタノールを入れ,カバーする。
- ラップで上部をつつみ,37℃, 15min.
- Stackingゲルの材料を三角フラスコにいれ,手で回しまぜる(下表参照)。
- ゲル上部の70%エタノールを捨て,ろ紙でしっかりと吸い取る。
- Stackingゲルをぎりぎりまでいれ,静かにコームを差す(泡がないか確認)。
- ラップで上部をつつみ,37℃, 20min.
7.5% Running gel
| 一枚分 | 二枚分 | |
|---|---|---|
| DW | 4.976ml | 9.952ml |
| L solution | 2.49ml | 4.976ml |
| N solution | 4.976ml | |
| 10% APS | 39.8μl | 79.6μl |
| TEMED | 10μl | 20μl |
10% Running gel
| 一枚分 | 二枚分 | |
|---|---|---|
| DW | 4.1ml | 8.2ml |
| L solution | 2.49ml | 4.98ml |
| N solution | 3.3ml | 6.6ml |
| 10% APS | 39.8μl | 79.6μl |
| TEMED | 10μl | 20μl |
12.5% running gel
| 一枚分 | 二枚分 | |
|---|---|---|
| DW | 3.39ml | 6.78ml |
| L solution | 2.49ml | 4.98ml |
| N solution | 4.17ml | 8.34ml |
| 10% APS | 39.8μl | 79.6μl |
| TEMED | 10μl | 20μl |
15% running gel
| 一枚分 | 二枚分 | |
|---|---|---|
| DW | 2.488ml | 4.976ml |
| L solution | 2.488ml | 4.976ml |
| N solution | 4.976ml | 9.952ml |
| 10% APS | 39.8μl | 79.6μl |
| TEMED | 10μl | 20μl |
stacking gel
| 一枚分 | 二枚分 | |
|---|---|---|
| DW | 2.98ml | 5.96ml |
| M solution | 1.26ml | 2.52ml |
| N solution | 0.77ml | 1.54ml |
| 10% APS | 16.8μl | 33.6μl |
| TEMED | 10μl | 20μl |
☆タンパク質の抽出☆
- 乳鉢に0.2gの藻体をとり,氷上で可溶可バッファーを800μl入れ粉砕する。
- 5mlチューブに全量入れ,3000rpm, 10min
- 上澄みを別のチューブに全量入れ,氷上
☆ローディング☆
4×sample buffer
0.5 M Tris-HCl pH 6.8 5ml [0.5M]
SDS 2.4g [12%(w/v)]
Glycerol 8ml [40%(v/v)]
2-mercapto ethanol 4ml [20%(v/v)]
| Bromophenol blue 0.8mg [0.004%(w/v)] |
Fill up to 20ml (DW)
- Gel moduleのシーリングプレートを開いて、重合していないゲル溶液をろ紙でふき取る。
- シーリングプレートのつまみをクランプの下側の窪みにはめ込む。
- 抽出液15μl, 4xバッファー5μl(updpwn)をPCRチューブにとり,pipetting。
- 100℃, 5minでヒートショック,スピンダウン(机上)。
- コームをゆっくりはずし,細く切ったろ紙でcellをきれいに。
- Runningバッファーを作製。
- 外側に1/3ぐらいRunningバッファーをいれる。
- Gel moduleを装着(下に泡をいれないように)。下に泡が入った場合にはシリンジを用いて泡を取り除く。
- 内側にRunningバッファーをいれる。
- 16μlをローディング。マーカは5μl
- 1枚で10mA,裏表で20mA、下ゲルに達したら1枚で20mA,裏表で40mA
☆染色☆
- バンドが下まで達しsample bufferがrunning bufferに出だしたところで,0に戻し,電源off。
- ガラス板をスパチュラではずし,Stackingゲルを切り取る。
- タッパにDWを入れ,そこにDWをかけながらゲルを流し入れ10minしんとう。
- DWをすて, CBB染色液をいれ,30minしんとう。
- 染色液を保存用ビンに戻し,脱色液を適量入れ,キムワイプを入れ30minしんとう。
- 廃液を廃液入れに入れ,タッパを洗浄。
染色希釈・脱色液
特級MeOH 300ml [30%(v/v)]
| 特級Acetic Acid 100ml [10%(v/v)] |
Fill up to 1 liter (DW)
10×染色液
特級MeOH 30ml [30%(v/v)]
| 特級Acetic Acid 10ml [10%(v/v)] |
Fill up to 100 ml (DW)
→200ml容ビーカーに調整し250mgのCoomassie Brilliant Blue R-250 (CBB)を入れて溶解させる。
☆ゲル乾燥☆
- アッセンブリーテーブルにボトムフレームと水でぬらしたセロファンをのせる。
- セロファンの上にゲルをのせる。
- ゲルの上にもう一枚水でぬらしたセロファンをのせる。このとき空気が入らないように注意すること。
- トップフレームをのせてクランプで締める。
- ドライヤーの中にフレームを入れる。タイマーを1~2時間にセットしてスタート。
☆ブロッティング☆
Transfer buffer
Tris 3.0g
Glycine 14.4g
SDS 1.0g
| 特級MeOH 200ml |
Fill up to 1liter(DW)
- ブロットモジュールの電極版をDWで洗浄する。
- ゲルと同じサイズのブロッティングペーパーをゲルの枚数×2枚準備する。カットしたペーパーはトランスファーバッファーに浸しておく。
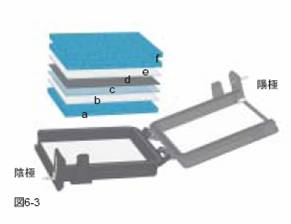
- メンブレンを同じサイズにカットする。ニトロセルロース、ナイロンメンブレンはDWにつけた後、PVDFメンブレンはメタノールにつけた後に2~5分間トランスファーバッファーに浸しておきます。下図のようにダクロンスポンジ(a,f)、ブロッティングペーパー(b,e)、ゲル(c)、メンブレン(d)を重ねる。2枚のゲルのブロッティングを同時に行う場合は、fで示した2枚のダクロンスポンジの間にb~eを重ねる。
メンブレンとゲルの間に空気が入らないように注意する。
(赤:陽極、黒:陰極)
- 陰極の上にa~fをのせ、ブロットモジュールを閉じタブを奥までしっかりとはめ込む。
- ブロットモジュールを300~350mlのトランスファーバッファーで満たす。
- ブロットモジュールを下部バッファータンクに設置する。下部バッファータンクを2~1.7Lの室温もしくは4℃に冷却したDWで満たす。
- 定電流300~400mAで1~2時間行う。